전기화학에 대해 책을 펴면, 미전공자들은 어려운 부분들이 너무 많습니다.
배터리를 조금 더 잘 이해하고 싶어서 책을 폈지만 막상 얼마 안가 다시 닫는 경우도 허다하다고 생각합니다.
그래서, 본 글에서는 '아주아주 간단하지만 배터리를 이해하기 위한 기초 전기화학'에 대해 정리해보고자 합니다.
딥한 내용은 다루지 않고, 직관적인 이해를 위해 다소 러프하게 설명했습니다.
※정의에 대해 엄밀하게 다루시는 전문가분들을 위한 글이 아니며, 흥미로 보시는것이 좋을것 같습니다.
- 사용한 모든 이미지에는 출처를 기재하였습니다. 저작권상 출처를 남겼음에도 문제가 되는 부분이 있다면 말씀주시면 수정하겠습니다.
전기화학이란?
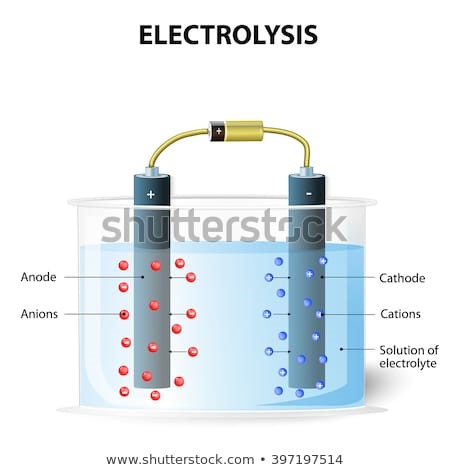
전기화학은 전기가 관여하는 화학반응을 의미합니다.
배터리의 방전처럼, 화학반응이 일어나면서 전기를 발생시키는것과 배터리충전 처럼, 전기를 가해 화학반응을 유도하는것입니다.
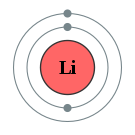
핵융합, 핵분열 같은 반응이 아닌이상 대부분의 화학반응은 전자의 이동으로 발생합니다.
리튬원자는 최외곽에 전자가 1개 있는데, 두번째 껍질에서는 8개의 전자가 있어야 안정성을 이루나, 리튬은 1개밖에 없기때문에 보통 이 1개 전자를 버리고자 하는 성질이 강합니다. 따라서 리튬이온은 Li+로 이온화 됩니다.
배터리의 충전과 방전을 하다보면, 이 리튬 이온이 음극과 양극을 왔다갔다하며 화학반응을 일으키고 이로 인해 전기에너지를 발생시킵니다.

활성화 에너지(Activation Energy)라는 개념도 알아두셔야합니다.
활성화 에너지란, 화학반응이 발생하기 위한 최소한의 에너지입니다.
상기 그림에서 A+B라는 화학상태가 C라는 상태로 변화하기 위해서는 언덕에 해당하는 활성화 에너지 이상의 에너지가 필요합니다.
이것의 가장 직관적인 예시가 물과 수증기입니다. 물을 자연상태로 그대로 둔다고해서 수증기가 되지 않습니다. 상압에서 100'C라는 열에너지를 가해주어야 비로소 끓기 시작하고 기화되는데요, 이렇듯 화학적 상태 변화를 위해서는 필요한 특정 에너지 임계치를 가지고 있습니다.
그렇다면, 배터리에는 이 활성화 에너지가 낮을수록 좋을까요 높을수록 좋을까요?
정답은 소재마다 다르다입니다.
전해질의 안정성 측면에서는 활성화 에너지가 높을수록 좋습니다. 배터리가 고온에서 스웰링이 발생하거나, 가연성 가스가 배출되는것은 전해질이 분해되기 때문입니다. 즉, 전해질이 분해되지 않도록 화학적 상태변화를 하기위한 활성화에너지가 높다면 더욱 안정해지겠지요.
전극의 특정 반응들은 활성화 에너지가 낮을수록 좋습니다. 예를들면, 전극 분말내부의 Diffusion이나 전극 계면의 화학반응들은 빠르게 일어날수록 배터리 퍼포먼스가 증가합니다. 화학반응이 빠르게 일어나기 위해서는 활성화 에너지가 낮을수록 좋습니다.

현대자동차에서 만든 '넥쏘(NEXO)' 라는 수소연료전지 자동차에서 '백금'이라는 촉매가 금액이 많이 비싸다는 얘기를 들어보신적 있으실겁니다. 수소전지에서 이 촉매가 필요한 이유가 바로 활성화 에너지를 낮추어 수전해반응을 더욱 빠르게 발생시키기 위함입니다.
한가지 더 예를들자면 Graphite와 다이아몬드입니다. 이 둘은 화학적으로 완벽하게 동일한 탄소 그자체입니다. 하지만, 다이아몬드 하면 가장 먼저 떠오르는게 단단함이시죠? 똑같은 화학 구조이지만 Graphite에서 탄소를 만들기위해서는 활성화에너지가 아주아주 높습니다. 그렇기때문에 다이아몬드는 단단하고 강건하며 비싸죠 (물론 최근 Lab Diamond라고 해서 인공적으로도 잘만들어내고 있어 핫합니다.)
화학반응과 전기
하기는 제가 예전에 작성했던 충방전시 전자와 리튬이온의 이동에 대해 정리한 글로, 보고오시면 이해가 쉽습니다.
https://limitsinx.tistory.com/11
리튬이온 배터리의 충방전 원리(The principle of lithium-ion battery)
*본론에 들어가기에 앞서 배터리를 이해하기 위한 사전지식 '산화환원반응'에 대해 정리하면 "전자를 잃은쪽은 산화수가 증가하고 산화되며, 전자를 얻는쪽은 산화수가 줄어들고 이때 잃은 전
limitsinx.tistory.com
전자공학을 하신 분들은 전류를 '전자의 흐름' 이라고 배우셨을겁니다.
하지만 이온의 흐름에 의한것도 전류입니다.
배터리를 예로들면, 전류는 Closed Loop(폐회로)를 형성하여야 흐를 수 있습니다. 개회로(Open Loop)의 경우 이론상 저항이 무한대이기때문에 전류는 0이기 때문입니다.

상기 그림을 보시면, 대부분은 전자의 이동에 의해 전류가 발생하는 윗쪽 도선부분만 전류가 흐를것이라고 생각합니다.
하지만, 전극 위에있는 도선만으로는 폐회로를 형성할 수 없습니다. 즉, 배터리는 도선으로도 전류가 흐르지만 배터리 전극 사이로도 전류가 흐릅니다.
그러면 여기서 질문이 있으실것입니다.
"배터리 전극사이(내부)로 전류가 흐르면 쇼트(Short)가 난것 아닌가요??"
맞습니다. 배터리 전극 사이에 전자의 이동에 의한 전류가 흐르면 쇼트가 나서 고장난것입니다.
하지만, 서두에서 말씀드렸다시피 전류는 '전자의 흐름'에 의한 전류와 '이온의 흐름'에 의한 전류로 나뉩니다.
즉, 외부도선으로 흐르는것은 전자의 흐름에 의한 전류이나, 전극사이 리튬이온이 이동하며 발생하는것은 이온의 흐름에 의한 전류이므로, 쇼트가 났다는것은 전극사이로 전자의 흐름에 의한 전류가 발생했다는것과 다른이야기가 됩니다.
정리하자면, 전류는 이온의 흐름과 전자의 흐름에 의한 완전한 전류 Closed Loop가 형성되었을때 비로소 발생합니다.
전기화학 셀(Cell)

전기화학 셀은 일반적으로 전극(Electrode), 전해질로 구성되어 있습니다.
Zn(아연), Cu(구리)에 의한 전기분해 실험... 으로 대부분의 전기화학책에 기본 설명이 되어있는데 저는 리튬이온 배터리를 예시로 설명드리겠습니다.
배터리 셀의 4대요소는 양극,음극,분리막,전해질입니다. 양극,음극이 결국 전극이기 때문에 전기화학에서 의미하는 셀과 동일합니다.
여기서 한개씩 개념을 정리해보겠습니다.
전극(Electrode)
하기는 제가 예전에 작성했던 충방전시 전자와 리튬이온의 이동에 대해 정리한 글로, 보고오시면 이해가 쉽습니다.
https://limitsinx.tistory.com/11
리튬이온 배터리의 충방전 원리(The principle of lithium-ion battery)
*본론에 들어가기에 앞서 배터리를 이해하기 위한 사전지식 '산화환원반응'에 대해 정리하면 "전자를 잃은쪽은 산화수가 증가하고 산화되며, 전자를 얻는쪽은 산화수가 줄어들고 이때 잃은 전
limitsinx.tistory.com
전극은 Cathode와 Anode로 나뉩니다. 이 부분에서 많은분들이 어려워하시는관계로, 꼼꼼히 읽어보심을 권장드립니다.
-Anode(산화극) : 전자를 잃어버리는 산화 반응이 일어나는 전극
-Cathode(환원극) : 전자를 받는 환원 반응이 일어나는 전극
다른 정의들을 보면, 상대방을 산화시키고... 이런식으로 전문가들을 위한 엄밀한 의미에서의 정의를 설명하기 위해 복잡하게 정리되어있는 글들이 많은데, 본 글을 읽으시는 분들은 위의 두줄만 딱 외우시면 됩니다.

그럼 이제 본격적으로 정리해보겠습니다.
일단, 매우 혼동스러워 하시는 부분들에 대해 정확하게 알고있습니다. 배터리의 '방전'을 기준으로 먼저 정리해보겠습니다.
배터리의 방전시에는 음극(Graphite)에 있는 전자들이 양극(NCM,LFP...)으로 이동합니다.
그 이유는, 전자는 양극을 좋아하죠. 음극에 있는 전자들이 자연스럽게 양극으로 이동하게 되며 이는 아주 자연스러운 현상입니다. 여기서 '자연스럽다'에 유의해주셔야합니다. 배터리는 본디 Closed Loop만 되면 방전하고자 하는 성격이 있습니다. 그것이 자연의 이치이기 때문입니다. 모든 소자들은 Unstable한 영역에서 Stable한 영역으로 가고자 하는 성질이 있습니다. 전자의 입장에서는 양극에 있는것이 Stable한것이기에 배터리는 방전이 자연스러운 현상이고, 이는 전자가 음극에서 양극으로 움직이는것을 의미합니다.
방전시 전자가 음극에서 양극으로 이동한다는것은, 리튬이온도 음극에서 양극으로 이동함을 의미합니다.
그 이유는, 리튬원자가 리튬이온과 전자로 나누어지기때문에 전자의 이동과 이온의 이동은 함께 발생하기 때문입니다.
따라서 배터리가 방전을 한다는것은 전자와 리튬이온이 음극에서 양극으로 가는것을 의미합니다.
여기서 '음극'의 리튬원자가 리튬이온으로 변화하면서 전자를 잃어버리게(산화) 됩니다. (상기 '전기화학이란?' 內리튬 설명 참조)
반대로 양극에 들어갈때는 전자와 리튬이온이 만나 리튬원자가 되기때문에 전자를 받는 화학 반응(환원)이 발생하.
따라서, 방전을 기준으로는 음극이 산화극(Anode)가 되고, 양극이 환원극(Cathode)가 됩니다.
그럼 이번에는 배터리의 '충전'을 기준으로 정리해보겠습니다.
배터리의 충전은 방전과 반대로, 배터리에 외부 전원을 연결하여 강제로 부자연스러운 현상을 만들어 주는것을 의미합니다. 방전이 자연스러운 현상이라했듯, 충전은 양극으로 이동해야 자연스러운 전자의 흐름을 거꾸로 만들어주는것을 의미합니다.
즉, 충전시에는 전자가 양극에서 음극으로 이동하며, 리튬이온 또한 같은 방향으로 이동합니다.
이때는 양극에 있던 리튬원자가 리튬이온과 전자로 나뉘게 되고(산화), 음극에서 만나 다시 리튬이온과 전자가 합쳐져(환원) 리튬원자가 됩니다. 즉, 충전시에는 음극이 환원극(Cathode), 양극이 산화극(Anode)가 됩니다.
"정리하자면, 배터리의 충전과 방전에 따라서 음극과 양극이 Cathode가 되기도 Anode가 되기도합니다. "
하지만! 이쪽 배터리 연구자들은 대부분 음극을 Anode, 양극을 Cathode라고 부릅니다.
그 이유는, 배터리입장에서는 자연스러운 현상이 방전이고 이때 음극이 Anode, 양극이 Cathode이기 때문입니다.
따라서, 앞으로는 배터리의 음극(Graphite+Si)을 Anode, 양극을 Cathode(LCO,LTO,LFP,NCM,NCA,...)라고 하셔도 됩니다.
(전기화학 하는사람들은 이렇게 부르는것을 싫어함. 엄밀한 정의가 아니기때문.)
※배터리 전극설계 설명
https://limitsinx.tistory.com/184
리튬이온배터리 셀 - II (셀 전극설계)
※참고하면 좋은 글 : 1. 리튬배터리 시스템에 대한 이해(배터리 팩 HW정리) https://limitsinx.tistory.com/14?category=960086 배터리 팩에 대한 이해(Analysis of Battery Pack, Battery System) "배터리?" "배터리"라고 하
limitsinx.tistory.com
전해질(Electrolyte)
전해질의 정의는 이온 전도성을 높여주는 물질을 의미합니다.
배터리에서는 당연히 전해질이 전자 전도성은 없고, 이온 전도성이 높아야하는데요
전자는 외부도선으로 흘러야 쓸수있기 때문이고, 내부에서 전자가 흐르는 경우를 '쇼트 났다'라고 부르는데 급격하게 온도가 올라가고 전류가 커져서 열폭주까지 도달할수 있기 때문입니다.
이런 성질을 만족하는 소재로 EC(에틸렌 카보네이트)와 LiPF6를 섞어서 쓰는것이 일반적입니다.
하지만, EC는 가연성 기체를 유발하고 불이붙는 성질이 있어 안정성에 한계점이 존재합니다. 그렇기때문에 전고체전지쪽으로 많이 연구가 되고 있습니다.
전고체전해질은 크게 3가지(고분자계, 산화물계, 황화물계)로 연구되고있는데요, 학계에서는 황화물계쪽으로 어느정도 개발방향성이 흘러가고 있으나 저는 고분자계가 더 괜찮지않나.. 개인적으로 생각하고 있습니다.
[참고] 예전에 정리한 전고체 글
https://limitsinx.tistory.com/188
전고체전지(ASSB, All Solid State Battery)에 대한 이해 - I
※ 리튬이온배터리의 기초적인 부분은 하기글 참고해주세요 https://limitsinx.tistory.com/183?category=960086
limitsinx.tistory.com
분리막(Separator)
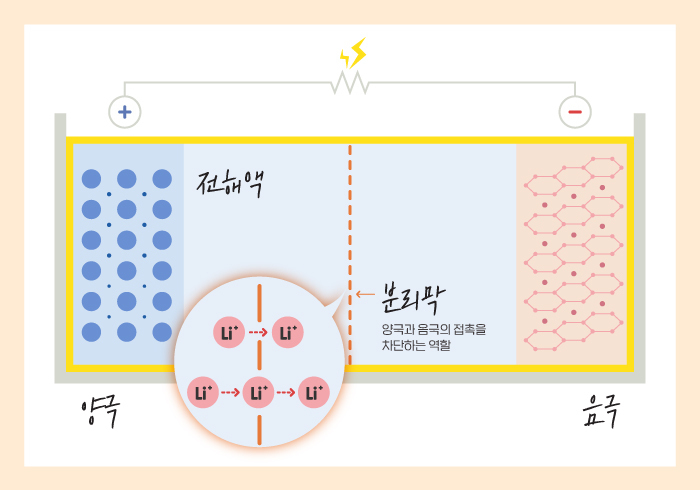
전해질의 전자전도도 낮지만, 절대 전자가 통과하지 못하도록 하나의 벽이 더 있는것이 분리막입니다.
분리막은 Porous(다공성)구조로, 이온은 통과시키지만 전기전도는 되지 않도록 하는 소재를 사용합니다.
일반적으로 폴리프로필렌(PP)를 많이 사용하며, 수~수십 micrometer 단위로 얇은 막입니다.
전극 리튬플레이팅-덴드라이트에 의해 분리막이 관통되어 찢기는 경우가 있는데, 이것을 막기위한 세라믹코팅 방식도 있고(CCS ; Ceramic Coated Separator) 이외에도 MFS(Multi Functional Separator), MCS(Multi Coated Separator)등 배터리의 안전성 확보를 위한 다양한 분리막들이 연구되고 있습니다.
※ [참고] 전해질, 분리막 상세 정리글
https://limitsinx.tistory.com/185
리튬이온배터리 셀 - III (전해질, 분리막)
※참고하면 좋은 글 : 1. 리튬배터리 시스템에 대한 이해(배터리 팩 HW정리) https://limitsinx.tistory.com/14?category=960086 배터리 팩에 대한 이해(Analysis of Battery Pack, Battery System) "배터리?" "배터리"라고 하
limitsinx.tistory.com
전기화학-배터리 Terminology
전기화학-배터리쪽을 이해하기 위한 중요한 Terminology에 대해 정리해보겠습니다.
1. 전위(Potential)[V] : 양의 단위전하를 무한대에서 그 상(Phase)로 가져오는데 필요한 에너지
→ 사전적 정의가 어려운데요, 쉽게는 해당 소재(제품)의 고유한 전기적 위치에너지라고 보시면 됩니다.
2. 전압(Voltage)[V] : 두 전극의 전위차
→ 양극과 음극의 전위차를 전압이라고 합니다.
예를들어, NCM 양극재의 전위가 3.7V라고 가정하고 Graphite의 전위가 0.1V라고 가정하면 이 셀의 전압 3.6V가 됩니다.
3. 용량(Capacity)[C, Ah] : 저장되어 있는 전하량
→ 배터리의 용량. 즉, 휴대폰보시면 80% 90%이렇게 용량표시가 되는데 이것이라고 보시면 됩니다.
※ 엄밀하게는 %단위는 SOC(State of Charge)로, 이것을 계산하기 위한 실제용량은 C,Ah 단위
+a) 쿨롱이라고 하면 쪼시는분들이 많으신데 전혀 그럴필요 없습니다. Ah는 1시간단위에서의 용량이고 C는 초단위에서의 용량입니다. 즉, Ah*3600 하면 쿨롱 단위가 됩니다.
하지만, 배터리를 하시는 분들은 Ah단위로 보시는것이 좋습니다. 후술될 C-rate와 직접적으로 연관되어있기 때문입니다.
4. 에너지(Energy)[Wh] : 일을 할 수 있는 능력
→ 어렵게 생각할것 없이, 용량에 전압을 곱한값입니다.
5. C-rate : 배터리를 완전 충전 또는 방전하는데 걸리는 시간을 전류로 표시한것.
→ 여기서 많이 혼동하시는데요 명확하게 정리해드리겠습니다.
1C-rate : 1시간동안 사용가능한 전류
2C : 0.5시간 동안 사용가능한 전류
0.5C : 2시간동안 사용가능한 전류
예를들어, 100Ah셀을 사용한다고 하면 100A로 한시간동안 충전/방전이 가능하다는 이야기죠? 그러면 100A가 이 셀의 1C-rate입니다.
그러면 2C-rate는 200A가 되겠죠. 200A로 100Ah셀을 사용하면 30분간 충전/방전이 가능하게 됩니다.
반대로 0.5C-rate인 50A로 100Ah셀을 사용하면, 낮은 전류니까 훨씬 길게 2시간까지 사용가능하게 됩니다.
이 3가지 예시만 명확하게 머릿속에 넣어두신다면 어떤 C-rate든 숫자 대입해서 즉각 활용 가능합니다.
전기화학만해도 한학기 분량의 강의분량이기 때문에 모든것을 정리할수는 없었습니다.
하지만, 배터리를 이해하기 위한 정도의 '기초 전기화학'을 파악하시기 용이하도록 글을 정리해보았습니다.
전문가분들은 이글을 읽지않으셔도 엄밀한 정의까지 모두 알고계시겠지만, 취미/투자 혹은 한번 공부해보고자 마음먹은 분들께는 전기화학이라는 과목 자체가 워낙 허들이 높기때문에 이분들을 위해 간략하게 작성해보았습니다.
모쪼록 도움이 되셨으면 좋겠습니다.
'Battery > Battery engineering' 카테고리의 다른 글
| 전고체전지(ASSB, All Solid State Battery)에 대한 이해 - I (8) | 2021.11.14 |
|---|---|
| 리튬이온배터리 셀 - III (전해질, 분리막) (2) | 2021.11.07 |
| 리튬이온배터리 셀 - II (셀 전극설계) (8) | 2021.11.07 |
| 리튬이온배터리 셀 - I (전기차용 배터리 셀의 종류) (4) | 2021.11.07 |
| LUMO(Lowest Unoccupied Molecular Orbital)과 HOMO에 대한 간단한 이해 (4) | 2020.12.14 |




댓글